Pengertian Kimia
Kimia (dari
bahasa Arab:
كيمياء, transliterasi:
kimiya = perubahan benda/zat atau
bahasa Yunani: χημεία, transliterasi: khemeia) adalah
ilmu yang mempelajari mengenai komposisi, struktur, dan sifat zat atau
materi dari skala
atom hingga
molekul
serta perubahan atau transformasi serta interaksi mereka untuk
membentuk materi yang ditemukan sehari-hari. Kimia juga mempelajari
pemahaman
sifat dan interaksi atom individu dengan tujuan untuk menerapkan
pengetahuan tersebut pada tingkat makroskopik. Menurut kimia modern,
sifat fisik materi umumnya ditentukan oleh struktur pada tingkat atom yang pada gilirannya ditentukan oleh
gaya antaratom dan
ikatan kimia.
Pengertian Fisika
Fisika (
bahasa Yunani:
φυσικός (
fysikós), "alamiah", dan
φύσις (
fýsis), "alam") adalah sains atau ilmu tentang
alam dalam makna yang terluas. Fisika mempelajari gejala alam yang tidak hidup atau
materi dalam lingkup
ruang dan
waktu. Para
fisikawan
atau ahli fisika mempelajari perilaku dan sifat materi dalam bidang
yang sangat beragam, mulai dari partikel submikroskopis yang membentuk
segala materi (fisika partikel) hingga perilaku materi alam semesta
sebagai satu kesatuan
kosmos.
Sistem Periodik Unsur
A. Perkembangan Periodik Unsur
1. Berdasarkan Sifat Logam dan Non Logam
Unsur-unsur yang ada di alam dikelompokkan ke dalam 2 kelompok yaitu
logam dan non logam. Pengelompokan ini merupakan metode paling sederhana
, dilakukan dengan cara mengamati
ciri-ciri fisiknya
2. Berdasarkan Hukum Triade Dobereiner
Tahun 1817 Dobereiner menemukan adanya beberapa kelompok tiga unsur yang
memiliki kemiripan sifat, yang ada hubungannya dengan massa atom.
Kelompok ini dinamakan triade. Berdasarkan eksperimennya disimpulkan
bahwa berat atom unsur kedua hampir sama atau mendekati berat rata-rata
dari unsur sebelum dan
sesudahnya.
Pengelompokkan unsur dari Dobereiner dapat digambarkan sebagai berikut:

3. Hukum Oktaf dari Newland
Unsur-unsur dikelompokkan berdasarkan kenaikan massa atom relatifnya (Ar).
Unsur ke-8 memiliki sifat kimia mirip dengan unsur pertama; unsur ke-9
memiliki sifat yang mirip dengan unsur ke-2 dst. Sifat-sifat unsur yang
ditemukan berkala atau periodik setelah 8 unsur disebut Hukum Oktaf.

Unsur H sifatnya sama dengan unsur F,unsur Li sifatnya sama dengan unsur Na dan seterusnya 3.Berdasarkan Periodik Mendeleev
Lothar Meyer lebih mengutamakan sifat-sifat kimia unsur sedangkan Mendeleev lebih
mengutamakan kenaikan massa atom.
Menurut Mendeleev : sifat-sifat unsur adalah fungsi periodik dari massa atom
relatifnya. Artinya : jika unsur-unsur disusun menurut kenaikan massa atom relatifnya, maka
Sifat tertentu akan berulang secara periodik.
4.Sistem Periodik Modern (Sistem Periodik Panjang)
Dikemukakan oleh Henry G Moseley, yang berpendapat bahwa sifat-sifat
fisis dan kimia unsur merupakan fungsi periodik dari nomor atomnya
.Artinya : sifat dasar suatu unsur ditentukan oleh nomor atomnya bukan
oleh massa atom relatifnya (Ar).
Pengelompokkan ini dikenal dengan sistem periodik panjang yang diketahui
dengan nama Sistem Periodik Modern. Sistem ini terdiri dari 2 hal yaitu
golongan (lajur vertikal) dan periode(lajur horisontal)
 http://upload.wikimedia.org/wikipedia/commons/thumb/8/84/Periodic_table.svg/450px-Periodic_table.svg.png
http://upload.wikimedia.org/wikipedia/commons/thumb/8/84/Periodic_table.svg/450px-Periodic_table.svg.png
B.Golongan dan Periode Unsur-Unsur dalam Tabel Periodik
1. Golongan
Golongan adalah lajur tegak pada Tabel Peiodik Unsur. Unsur-unsur yang
ada dalam satu lajur tegak adalah unsur-unsur segolongan, terdapat 8
golongan utama dan 8 golongan transisi.
Golongan utama tersebut adalah:
a. Golongan I A (alkali) terdiri dari unsur-unsur H, Li, Na, K, Rb,Cs,Fr
b. Golongan II A (alkali tanah) terdiri dari unsur-unsur Be, Mg, K,Sr,Ba,Ra
c. Golongan III A ( aluminum) terdiri dari unsur-unsur B,Al,Ga,In,Tl
d. Golongan IV A (karbon) terdiri dariunsur-unsur C,Si,Ge,Sn,Pb
e. Golongan V A (nitrogen) terdiri dari unsur-unsur N,P,As,Sb,Bi
f. Golongan VI A (oksigen) terdiri dari unsur-unsur O,S,Se,Te,Po
g. Golongan VII A (halogen) terdiri dari unsur-unsur F,Cl,Br,I,At
h. Golongan VIII A (gas mulia) terdiri dari unsur-unsur He,Ne,Ar,Kr,Xe,Rn
2. Periode
Perioda adalah lajur horisontal dalam sistem periodik modern terdiri dari 7 periode
a. Periode 1 (periode sangat pendek) berisi 2 unsur
b. Periode 2 (periode pendek) berisi 8 unsur
c. Periode 3 (periode pendek) berisi 8 unsur
d. Periode 4(periode panjang) berisi 18 unsur
e. Periode 5 (periode panjang) berisi 18 unsur
f. Periode 6 (periode sangat panjang ) berisi 32 unsur
g. Periode 7 (periode sangat panjang) berisi 28 unsur,belum lengkap karena maksimum 32 unsur
Sistem periodik modern (SPU) disusun berdasarkan kenaikan nomor
atom (lajur horizontal atau periode) dan kemiripan sifat (lajur vertikal
atau golongan).
Sistem periodik modern terdiri atas 7 periode dan 8 golongan. Berdasarkan golongannya, unsur-unsur SPU dibedakan menjadi:
a. Golongan utama (Golongan A)
b. Golongan transisi (Golongan B)
Berdasarkan jenis orbital yang ditempati oleh elektron terakhir,
unsur-unsur dalam sistem periodik dibagi atas blok s, blok p, blok d,
dan blok f.
a. Blok s: golongan I A dan II A. Blok s tergolong logam aktif, kecuali H (nonlogam) dan He (gas mulia).
b. Blok p: golongan III A sampai dengan VIII A. Blok p disebut juga
unsur wakil karena terdapat semua jenis unsur (logam, nonlogam, dan
metaloid).
c. Blok d: golongan III B sampai II B. Unsur blok d disebut juga unsur transisi, semuanya
tergolong logam.
d. Blok f: unsur blok f ini disebut juga unsur transisi dalam, semuanya terletak pada golongan IIIB, periode 6 dan 7.
1) Periode 6 dikenal sebagai deret lantanida (4f).
2) Periode 7 dikenal sebagai deret aktinida (5f)
C. Hubungan Konfigurasi Elektron dengan Sistem Periodik
Hubungan antara letak unsur dalam sistem periodik dengan konfigurasi elektronnya
adalah sebagai berikut.
1. Nomor periode sama dengan jumlah kulit
2. Nomor golongan sama dengan jumlah elektron valensi
Contoh soal:
Tentukan golongan dan periode dari unsur !
Jawab:
mempunyai nomor atom 35 sehingga konfigurasi elektronnya X = 2.8.18.7
Elektron valensi= 7 ► Golongan VII A, jumlah kulit 4►periode 4
Sumber:
http://kimia-asyik.blogspot.com/2009/04/sistem-periodik-unsur.html
Sifat Keperiodikan Unsur
Sifat periodik adalah sifat yang berubah secara beraturan sesuai
dengan kenaikan nomor Atom, yaitu dari kiri kekanan dalam satu periode
atau dari kiri kekanan dalam satu golongan.
1. Jari-jari Atom
Jari-jari atom adalah jarak dari inti hingga kulit elektron terluar.

Semakin besar nomor atom unsur-unsur segolongan, semakin banyak
pula jumlah kulitelektronnya, sehingga semakin besar pula jari-jari
atomnya.
Jadi : dalam satu golongan (dari atas ke bawah), jari-jari atomnya semakin besar.
Dalam satu periode (dari kiri ke kanan), nomor atomnya bertambah yang
berarti semakin bertambahnya muatan inti, sedangkan jumlah kulit
elektronnya tetap. Akibatnya tarikan inti
terhadap elektron terluar makin besar pula, sehingga menyebabkan semakin kecilnya jari-jari
atom.
Jadi : dalam satu periode (dari kiri ke kanan), jari-jari atomnya semakin kecil.
2.Afinitas Elektron
Adalah energi yang dilepaskan atau diserap oleh atom netral dalam bentuk
gas apabila menerima sebuah elektron untuk membentuk ion negatif
Unsur golongan utama memiliki afinitas elektron bertanda negatif, kecuali golongan IIA dan VIIIA.
Afinitas elektron terbesar dimiliki golongan VIIA..
Dalam satu golongan (dari atas ke bawah), harga afinitas elektronnya semakin kecil.
Dalam satu periode (dari kiri ke kanan), harga afinitas elektronnya semakin besar.
Contoh: Cl(g) + e¯ → Cl¯(g) (∆H=-348kj)
3.Energi Ionisasi
Adalah energi minimum yang diperlukan atom netral dalam wujud gas untuk
melepaskan satu elektron sehingga membentuk ion bermuatan +1 (kation).
Jika atom tersebut melepaskan elektronnya yang ke-2 maka akan diperlukan
energi yang lebih besar (disebut energi ionisasi kedua), dst.
EI 1< style=”font-style: italic;”>bertambah sehingga gaya tarik
inti terhadap elektron terluar semakin kecil. Akibatnya elektron terluar
semakin mudah untuk dilepaskan.
Dalam satu periode (dari kiri ke kanan), EI semakin besar karena
jari-jari atom semakinkecil sehingga gaya tarik inti terhadap elektron
terluar semakin besar/kuat. Akibatnya elektron terluar semakin sulit
untuk dilepaskan .
Contoh : 11 Na + energi ionisasi → Na
+ + e
4.Keelektronegatifan
Adalah kemampuan suatu unsur untuk menarik elektron dalam molekul suatu
senyawa (dalam ikatannya).Diukur dengan menggunakan skala Pauling yang
besarnya antara 0,7 (keelektronegatifan Cs) sampai 4 (keelektronegatifan
F).
Dalam satu periode (dari kiri ke kanan), harga keelektronegatifan semakin besar.
Dalam satu golongan (dari atas ke bawah), harga keelektronegatifan semakin kecil.
Dalam satu golongan dari atas ke bawah
1.Afinitas elektron semakin kecil
2.Jari-jari atom semakin besar
3.Energi ionisasi semakin kecil
4.Elektronegativitas semakin kecil
Dalam satu perioda dari kiri ke kanan
1.Jari-jari atom semakin kecil
2. Afinitas elektron semakin besar
3. Energi ionisasi semakin besar
4. Elektronegativitas semakin besar
Contoh soal:
Tentukan unsur mana yang mempunyai keelektronegatifan yang lebih besar?
a. Karbon(nomor atom= 6) dengan Oksigen (nomor atom=8)
b. Fluorin (nomor atom=9) dengan Klorin(nomor atom=17)
Jawab
a. Karbon mempunyai konfigurarasi elektron C= 2.4, terletak pada golongan IVA dan periode 2
Oksigen mempunyai konfigurasi elektron O=2.6, terletak pada golongan VI A dan periode 2
Dalam satu periode keelektronegatifan dari kiri ke kanan semakin
besar.Letak O sebelah kanan dari C sehingga keelektronegatifan O lebih
besar dari C
b. Fluorin mempunyai konfigurasi elektron F=2.7, terletak pada golongan VII A dan periode 2
Klorin mempunyai konfigurasi elektron Cl=2.8.7, terletak pada golongan VII A dan periode 3
Dalam satu golongan keelektronegatifan dari atas ke bawah semakin kecil.
Letak Cl dibawah F sehingga keelektronegatifan Fluorin lebih besar dari
Cl.
Pengertian energi
Definisi energi adalah daya kerja atau tenaga, energi berasal dari
bahasa Yunani yaitu energia yang merupakan kemampuan untuk melakukan
usaha. Energi merupakan besaran yang kekal, artinya enegi tidak dapat
diciptakan dan dimusnahkan, tetapi dapat diubah dari bentuk satu ke
bentuk yang lain. Ditinjau dari asalnya energi mempunyai bermacam-macam
bentuk seperti berikut :
- Energi potensial
- Energi kinetic
- Energi kimia,
- Energi kalor
- Energi listrik
- Energi bunyi
- Energi nuklir
- Energi radiasi
WUJUD ZAT DAN PERUBAHANNYA
Berdasarkan wujudnya, zat dapat dibedakan menjadi tiga
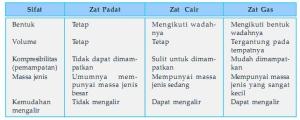
yaitu zat padat, zat cair, dan zat gas. Bagaimana sifat-sifat dari
wujud zat tersebut? Wujud zat dapat berubah. Hal
ini pengaruhi oleh adanya kalor. Marilah kita pelajari lebih lanjut
agar lebih jelas
- Sifat Zat Berdasarkan Wujudnya
Zat padat adalah zat yang mempunyai bentuk dan volume tetap. Dilihat
dari susunan molekul dan ikatan antarmolekulnya, zat padat mempunyai
susunan molekul yang teratur dan gaya tarik-menarik antarmolekulnya
yang kuat. Contoh zat padat antara lain batu, meja, kapur tulis, papan
tulis, dan pensil. Dapatkah kamu menyebutkan contoh zat padat lainnya
yang ada di sekitarmu?
Adapun zat cair adalah zat yang mempunyai volume tetap, tetapi
bentuknya selalu berubah-ubah mengikuti tempatnya. Dilihat dari susunan
molekul dan ikatan antarmolekulnya zat cair mempunyai susunan molekul
yang kurang teratur dan jarak antarmolekulnya yang agak renggang
sehingga gaya tarik menarik antarmolekulnya relatif lebih rendah
dibandingkan dengan zat padat. Contoh zat cair antara lain air sirop,
air teh, dan air mineral. Apakah gas itu? Gas adalah zat yang mempunyai
bentuk dan volume yang tidak tetap. Hal ini disebabkan karena susunan
molekul-molekul gas sangat tidak teratur sehingga gaya tarik-menarik
antarmolekulnya sangat lemah. Contoh zat gas adalah udara. Perbedaan
sifat-sifat zat padat, zat cair, dan zat gas dapat kamu lihat pada
tabel.
Tabel : Sifat-sifat zat padat, cair, dan gas
Nah, dari uraian tersebut kamu telah memahami bahwa zat padat, zat
cair, dan gas tersusun dari beberapa molekul. Molekul ini merupakan
komponen pembangun suatu zat yang sangat aneh karena molekul-molekul
tersebut terus bergerak, kecuali pada suhu teoritis yang disebut suhu
nol mutlak.
Apakah suhu nol mutlak itu? Suhu nol mutlak adalah suhu 0 K atau -273
°C. Tingkat panas suatu zat disebut suhu zat. Kamu dapat mengukur suhu
zat dengan alat yang dinamakan termometer.
Laju gerak molekul secara bertahap berkurang bersama turunnya suhu.
Saat mencapai suhu kira-kira -273,16 °C atau 0 K gerak molekul itu
berhenti dan tidak ada lagi panas yang dapat diukur. Dalam gas terdapat
sejumlah tarikan tertentu antara molekulnya. Jika suhu gas itu
diturunkan, gerak molekulnya akan bertambah lamban. Molekul-molekul itu
tidak lagi berjauhan sehingga tarikan di antara molekul tersebut menjadi
lebih kuat. Jika suhunya cukup rendah, molekul- molekul gas akan
mengumpul dan gas itu akan menjadi zat cair. Apabila suhunya diturunkan
terus, gerakan molekul akan semakin lamban dan gaya tarikannya akan
semakin kuat sehingga lama-kelamaan zat cair itu berubah menjadi zat
padat. Zat padat menempati ruang yang lebih kecil daripada gas.
Apakah zat cair dapat berubah menjadi gas?
Tentunya kamu sudah mengetahui bahwa jika baju basah digantung di
udara terbuka, lama-kelamaan baju akan kering. Hal ini membuktikan
bahwa zat cair yang terdapat dalam baju basah dapat berubah menjadi gas
jika mendapatkan panas dari lingkungan sekitarnya. Contoh lainnya, yaitu
ketika kamu meletakkan semangkuk air dalam ruangan dengan pemanasan
yang baik, permukaan air lama-kelamaan akan turun dan pada suatu saat
airnya akan lenyap sama sekali. Kedua peristiwa ini dinamakan penguapan.
- Susunan dan Gerak Partikel Suatu Zat
Pernahkah kamu mengamati orang yang sedang menggergaji kayu? Kayu
yang digergaji akan menghasilkan serbuk-serbuk kayu. Serbuk-serbuk kayu
tersebut sebenarnya merupakan zat penyusun dari kayu. Jika kamu amati
serbuk kayu tersebut dengan menggunakan mikroskop elektron, kamu dapat
melihat partikel-partikel sangat kecil yang saling berikatan. Nah,
partikel-partikel inilah yang sebenarnya memengaruhi sifat-sifat pada
zat padat, zat cair, dan zat gas.
Tahukah kamu apakah partikel itu? Partikel atau molekul adalah
bagian terkecil dari suatu zat yang masih memiliki sifat zat tersebut.
Sebagai contoh ketika kamu membuat teh manis dengan menggunakan gula
pasir. Saat gula pasir dimasukkan ke dalam air teh panas maka akan
terjadi tumbukan antara partikel-partikel gula pasir dengan partikel air
sehingga gula pasir akan larut. Gula pasir ini akan lebih cepat larut
karena air yang kamu gunakan adalah air panas. Pelarutan akan lebih
cepat lagi jika kamu mengaduknya. Partikel-partikel gula pasir dalam
wujud cair bergerak ke seluruh air teh yang terdapat dalam gelas
sehingga air teh tadi menjadi manis. Hal ini membuktikan bahwa partikel
masih mempunyai sifat yang sama dengan zat asalnya. Tahukah kamu
bagaimana susunan dan gerak partikel pada berbagai wujud zat? Perhatikan
gambar dibawah ini!
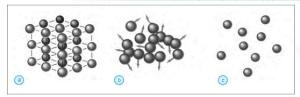
Gambar : (a) Susunan partikel zat padat, (b) susunan partikel zat cair, dan (c) susunan partikel zat gas
a) Partikel Zat Padat
Zat padat tersusun atas partikel-partikel yang teratur dan mempunyai
jarak antarpartikel yang sangat rapat. Gaya tarik- menarik antarpartikel
zat padat sangat kuat. Hal ini menyebabkan partikel tidak dapat
bergerak secara bebas untuk berpindah tempat. Keadaan ini menyebabkan
zat padat dapat mempertahankan bentuk dan volumenya sehingga zat padat
selalu mempunyai bentuk dan volume yang tetap.
b) Partikel Zat Cair
Berbeda dengan zat padat, zat cair mempunyai susunan partikel yang
kurang teratur dan kurang rapat dibandingkan susunan partikel pada zat
padat. Hal inilah yang menyebabkan partikel-partikel dapat bergerak
bebas untuk berpindah tempat. Akan tetapi, partikel-partikel penyusun
zat cair tidak dapat memisahkan diri dari kelompoknya. Keadaan ini
menyebabkan volume zat cair selalu tetap, walaupun bentuknya selalu
berubah mengikuti tempatnya.
c) Partikel Zat Gas
Pada zat gas, jarak antarpartikel sangat berjauhan sehingga gaya
tarik-menarik antarpartikel sangat lemah. Partikel- partikel ini
bergerak sangat bebas dan cepat dalam wadahnya. Hal ini menyebabkan zat
gas tidak dapat mempertahankan bentuk dan volumenya sehingga bentuk dan
volume zat gas selalu berubah mengikuti ruang yang ditempatinya.
2. Kohesi dan Adhesi
Di antara partikel-partikel yang sejenis dan yang tidak sejenis dapat
terjadi gaya tarik-menarik antarpartikel. Gaya tarik- menarik
antarpartikel yang sejenis dinamakan kohesi, sedangkan gaya
tarik-menarik antarpartikel yang tidak sejenis dinamakan adhesi.
Pernahkah kamu mengamati permukaan raksa di dalam termometer?
Permukaan raksa pada termometer jika kamu amati dengan cermat akan
terlihat tidak datar, tetapi sedikit melengkung pada bagian raksa yang
menempel pada kaca, perhatikan gambar dibawah ini.
(a) Meniskus cekung dan (b) meniskus cembung.
Kelengkungan permukaan zat cair dalam sebuah tabung kaca ini
dinamakan meniskus. Meniskus ada dua macam, yaitu meniskus cekung dan
meniskus cembung. Nah, untuk memahami tentang meniscus cekung dan
meniskus cembung, lakukanlah kegiatan berikut:
Dari kegiatan di atas, kamu dapat melihat bahwa bentuk permukaan air
dan raksa tidaklah datar. Bentuk permukaan air pada tabung reaksi
terlihat cekung, peristiwa ini dinamakan meniskus cekung. Meniskus
cekung terjadi karena gaya tarik- menarik antarpartikel air dan kaca
(adhesi) lebih besar daripada gaya tarik-menarik antarpartikel air
(kohesi). Hal ini menyebabkan air membasahi dinding kaca.
Bentuk permukaan raksa pada tabung reaksi terlihat cembung, peristiwa
ini dinamakan meniskus cembung. Meniskus cembung terjadi karena gaya
tarik-menarik antarpartikel air dan kaca (adhesi) lebih kecil daripada
gaya tarik-menarik antar- partikel air (kohesi). Hal ini menyebabkan
raksa tidak membasahi dinding kaca.
Pernahkah kamu memerhatikan air pada daun talas? Air tidak dapat
membasahi daun talas karena tetesan air di daun talas selalu membentuk
bola-bola kecil. Atau dapat dikatakan gaya kohesi molekul-molekul air
lebih besar dari gaya adhesi molekul air dengan molekul daun talas.
Adanya adhesi selain menimbulkan meniskus juga menimbulkan
kapilaritas. Bagaimana peristiwa kapilaritas terjadi? Perhatikan
bagaimana minyak tanah pada kompor dapat naik melalui sumbu kompor.
Atau, perhatikan bagaimana air di dalam tanah dapat naik dari akar
sampai ke daun. Nah, agar kamu dapat mengetahui bagaimana peristiwa
tersebut dapat terjadi, lakukanlah kegiatan berikut.
Dari Kegiatan 2 kamu dapat mengamati bahwa tinggi permukaan air dalam
pipa kapiler lebih tinggi daripada tinggi air dalam bejana. Hal ini
berarti permukaan air naik dalam pipa kapiler. Jika diameter pipa
kapiler makin kecil, tinggi permukaan air dalam pipa kapiler makin
tinggi.
Pada pipa kapiler yang dimasukkan dalam wadah berisi air raksa,
tinggi permukaan raksa dalam pipa kapiler lebih rendah daripada tinggi
raksa dalam bejana. Hal ini berarti permukaan raksa turun dalam bejana.
Jika diameter pipa kapiler makin kecil, tinggi permukaan raksa dalam
pipa kapiler lebih rendah.
Gambar : Permukaan air pada pipa kapiler naik.
3. Perubahan Wujud Zat
Pernahkah kamu melihat embun? Embun yang kamu lihat pada daun terjadi
karena uap air dari udara. Peristiwa ini disebut mengembun, yaitu
perubahan wujud dari zat gas menjadi zat cair. Saat Matahari mulai
bersinar, embun menguap kembali.
Tahukah kamu contoh perubahan wujud zat yang lainnya? Seperti yang
telah dijelaskan di depan, wujud zat dibedakan atas zat padat, cair dan
gas. Ketika kamu memasak air, pernahkah kamu mengamati apa yang terjadi
ketika air dipanaskan? Air yang dipanaskan lama-kelamaan akan mendidih.
Ketika air mencapai suhu 100 °C pada tekanan 1 atm, air akan berubah
menjadi uap. Peristiwa perubahan wujud dari air (zat cair) menjadi uap
(zat gas) dinamakan menguap.
Nah, agar kamu lebih memahami bagaimana perubahan wujud suatu zat, lakukanlah kegiatan berikut.
Pada kegiatan 3 kamu dapat mengamati perubahan wujud air menjadi uap
yang disebut menguap dan perubahan wujud dari uap menjadi air yang
disebut mengembun.
Pernahkah kamu menyimpan kapur barus di lemari pakaianmu? Apa yang
terjadi dengan kapur barus yang telah disimpan cukup lama? Kapur barus
yang disimpan di udara terbuka lama-kelamaan akan habis. Tahukah kamu
peristiwa perubahan wujud apa yang terjadi pada kapur barus? Nah, agar
lebih memahaminya lakukanlah kegiatan berikut.
Kapur barus yang dipanaskan, akan berubah menjadi gas. Hal ini dapat
kamu rasakan dari bau gas yang tercium sebagai hasil pemanasan kapur
barus. Peristiwa perubahan wujud dari kapur barus (zat padat) menjadi
uap (zat gas) dinamakan menyublim. Peristiwa yang terjadi pada uap
kapur barus (zat gas) menjadi serbuk-serbuk putih mengkilap (zat padat)
yang menempel pada kertas putih dinamakan mengkristal.
Pernahkah kamu membuat es batu? Air dalam plastik ketika kamu
masukkan ke dalam lemari es (freezer) akan berubah menjadi es. Peristiwa
perubahan wujud dari air (zat cair) menjadi es (zat padat) dinamakan
membeku. Nah, ketika kamu ambil es batu, kemudian dibiarkan di tempat
terbuka, es batu tersebut lama-kelamaan akan berubah wujud menjadi air
kembali. Peristiwa perubahan wujud dari es batu (zat padat) menjadi air
(zat cair) dinamakan mencair atau melebur.
1. Sifat Fisika
Sifat fisika merupakan sifat materi yang dapat dilihat secara langsung
dengan indra. Sifat fisika antara lain wujud zat, warna, bau, titik
leleh, titik didih, massa jenis, kekerasan, kelarutan, kekeruhan, dan
kekentalan.
Sifat Fisik: Sifat yang tidak mengubah sifat kimia materi
Contoh dari sifat fisik adalah: warna, bau, titik beku, titik didih,
titik lebur, spektrum infra-merah, daya tarik (paramagnetik) atau
tolakan (diamagnetic) untuk magnet, opacity, viskositas dan densitas.
Ada lebih banyak contoh. Perhatikan bahwa masing-masing mengukur
properti tidak akan mengubah sifat dasar dari substansi.
2. Sifat kimia umumnya merujuk pada sifat suatu materi pada kondisi
ambien atau sekitar, yaitu pada suhu kamar, tekanan atmosfer, dan
atmosfer beroksigen). Sifat ini terutama timbul pada reaksi kimia dan
hanya dapat diamati dengan mengubah identitas kimiawi suatu zat. Sifat
kimia dapat digunakan untuk menyusun klasifikasi kimia.
Sifat kimia biasanya digunakan untuk menyatakan, antara lain:
a. elektronegativitas
b. potensial ionisasi
c. jenis ikatan kimia yang dibentuk, antara lain logam, ion, dan kovalen.
Sifat kimia: Properti yang mengubah sifat kimia materi tha
Contoh sifat kimia adalah: panas pembakaran, reaktivitas dengan air, PH, dan gaya gerak listrik.
Sifat yang lebih kita bisa mengidentifikasi untuk substansi, semakin
baik kita tahu sifat zat itu. Properti ini dapat membantu kita model
substansi dan dengan demikian memahami bagaimana zat ini akan
berperilaku dalam berbagai kondisi.
Pengertian Dimensi dan Besaran
Dimensi
besaran fisis diwakili dengan simbol, misalnya M, L, T yang mewakili
massa, panjang (mungkin dari istilah bahasa Inggris: length), dan waktu
(mungkin dari istilah bahasa Inggris: time). Sebagaimana terdapat satuan
turunan yang diturunkan dari satuan dasar, terdapat dimensi dasar
primer besaran fisis dan dimensi sekunder besaran yang diturunkan dari
dimensi dasar primer. Misalnya, dimensi besaran kecepatan adalah
jarak/waktu (L/T) dan dimensi gaya adalah massa × jarak/waktu² atau
ML/T2.
Satuan
dan dimensi suatu variabel fisika adalah dua hal berbeda. Satuan
besaran fisis didefinisikan dengan perjanjian, berhubungan dengan
standar tertentu (contohnya, besaran panjang dapat memiliki satuan
meter, kaki, inci, mil, atau mikrometer), namun dimensi besaran panjang
hanya satu, yaitu L. Dua satuan yang berbeda dapat dikonversikan satu
sama lain (contohnya: 1 m = 39,37 in; angka 39,37 ini disebut sebagai
faktor konversi), sementara tidak ada faktor konversi antarlambang
dimensi.
Berikut adalah tabel yang menunjukkan dimensi dan satuan tujuh besaran dasar dalam sistem SI
| Besaran dasar | Dimensi | Satuan SI |
| Massa | M | kg |
| Panjang | L | m |
| Waktu | T | s |
| Suhu | ? | K |
| Arus listrik | E | A |
| Intensitas cahaya | I | cd |
| Jumlah zat | A |
mol
|
http://andriworldwide.blogspot.com/2011/05/pengertian-dimensi-besaran-dan-satuan.html
http://omiimo.wordpress.com/ipa1/sifat-fisika-kimia/sifat-fisika-kimia/
http://dsofina.wordpress.com/2011/01/10/a-sifat-zat-berdasarkan-wujudnya/
http://id.shvoong.com/exact-sciences/physics/2110370-pengertian-energi/
http://id.wikipedia.org/wiki/Fisika
http://id.wikipedia.org/wiki/Kimia












Tidak ada komentar:
Posting Komentar